肠道健康资讯
压力、肠道菌群和抑郁症
2022-09-23 16:36 来源:新营养
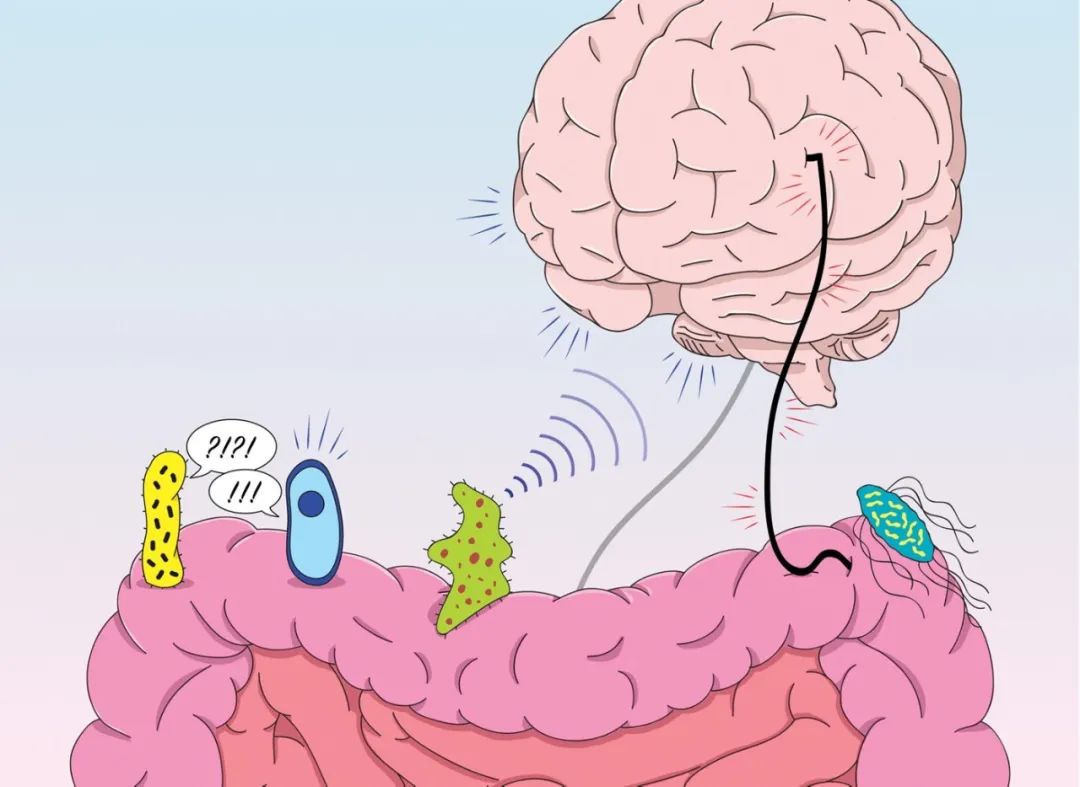
近十几年来,科学家、研究人员、媒体和普通大众开始对“脑-肠-微生物轴”这一新兴概念感到兴奋,他们专注于肠道菌群的改变如何自下而上地促进脑部疾病的发生。
其实,脑-肠-微生物轴中的信号传递是循环的,信号在多个反馈循环中沿着两条主要途径传递:从肠道和肠道微生物到大脑自下而上的交流以及从大脑到肠道和肠道微生物的自上而下的交流。这种双向交流深刻地影响着肠道和大脑的健康。
1. 慢性压力和脑-肠-微生物轴
正如现代生活方式促进了肠道和肠道微生物之间不匹配一样,它们也在大脑水平上促进了类似的差异,产生了另一种不匹配,那就是我们古老的压力反应系统和现代社会数量空前的、通常不会危及生命的压力之间的不匹配。
我们的神经系统偶尔会因紧急的、危及生命的危险而触发“战斗或逃跑”反应,这曾经让我们的祖先躲避了被捕食的危险,对于人类的生存至关重要,但是如今,这种反应往往是由不太严重的威胁所触发的。这种高水平的感知生理压力和慢性焦虑已经产生了严重的后果,比如破坏了脑-肠-微生物轴的关键信号传递。
有许多充分的证据表明,急性和慢性压力会对脑-肠-微生物轴产生影响。释放到肠道的去甲肾上腺素等压力介质可以激活微生物基因,增加细菌与肠道免疫系统的接触。压力也会改变整个肠道的收缩和蠕动,影响食物通过肠道的时间,进而影响微生物的栖息地和食物供应。此外,压力还会增加肠道渗透性,造成众所周知的“肠漏”,这可能导致肠道免疫系统的低度激活。
过去我们把肠道健康的变化单纯归因于不健康的饮食,但是很明显,它也可能在一定程度上受到大脑向肠道发送的慢性压力信号所引起,这些信号会改变肠道微生物信号分子,然后向大脑发送警报反馈。
复杂的大脑疾病不能用单一的因素来解释,而是需要更全面的网络科学视角,长期的压力和焦虑,加上不健康的饮食和缺乏有规律的运动,会对肠道健康产生协同的有害影响。
2. 肠道微生物和抑郁症
关于肠道菌群影响大脑健康的研究在很大程度上是基于动物研究的结果,比如那些完全不携带任何肠道微生物的“无菌”小鼠,它们会表现出异常的情绪行为以及学习和记忆缺陷。这些令人大开眼界的研究证实,大脑从肠道及其肠道菌群接收到的信号可以调节大脑功能和行为。
那么,肠道微生物数量、多样性或功能的变化是否与重度抑郁症有某种联系呢?
近年来,研究人员进行了一系列有意思的实验,研究人员将抑郁症患者的粪便转移到无菌老鼠或抗生素清除肠道细菌的老鼠体内,目的是为了证明在抑郁患者中发现的肠道菌群的改变是否是他们情绪下降的直接原因。结果很有意思,这些接受了粪菌移植的老鼠会开始表现出抑郁样的行为。这样的实验明确证明人类粪便微生物及其代谢产物转移可以改变老鼠行为和大脑生物化学。

2016年,另外两个实验进一步证实了这一发现。一项是由来自我国重庆多个科学机构的研究人员合作完成的,另一项是由爱尔兰科克大学的研究人员发现的。研究人员将重度抑郁症患者的粪便转移到无菌小鼠(我国的研究)和抗生素清除肠道细菌的大鼠(爱尔兰的研究)中。
在这两个实验中,接受粪便移植的动物也同样都表现出类似抑郁的行为,也就是说,它们的行为反映了人类抑郁症的特征。此外,这些老鼠表现出与抑郁症患者一样的肠道菌群紊乱。这两项研究都表明,抑郁症患者肠道中的某些微生物及其代谢物,比如色氨酸代谢物犬尿氨酸,会影响小鼠的行为举止,产生焦虑的行为和大脑功能。
然而,我们需要知道的是,从实验室小鼠的研究中,我们能转化的信息是有限的。老鼠和人类之间的差别太大了。实验室的老鼠是近亲繁殖的,这使得它们在基因上无法区分。它们都在相同的条件下长大,吃着相同的食物,生活在相同的温度下,经历相同的早期生活环境。重要的是,人类大脑的复杂性及其在产生情感方面的作用与老鼠大脑截然不同。
尽管如此,许多研究人员仍然试图寻找一种普遍的“抑郁症微生物特征”,即可能与人类抑郁症有关的肠道菌群及其产生的特定代谢物。
2015年,浙江大学第一附属医院传染病诊治国家重点实验室的研究团队发现,仅仅根据研究对象的肠道菌群组成就可以将抑郁者或非抑郁者区分开来。更具体地说,当研究人员将46名诊断为重度抑郁症的患者和30名没有抑郁症的健康对照者的粪便样本中的微生物进行比较时,他们发现抑郁症患者的拟杆菌门、变形菌门和放线菌门细菌数量较多,但是栖粪杆菌属的细菌较少,这是隶属于厚壁菌门的一个细菌属。
厚壁菌门丰富高被认为是肠道健康的标志,也与抗炎特性有关,生活在非洲坦桑尼亚的原始狩猎部落的哈扎人就是如此。研究人员也发现,粪便中这些有益微生物越多,患者的抑郁程度就越低。
然而,其它研究将抑郁症患者和健康对照的肠道菌群组成进行比较,得出了不同的、有时甚至矛盾的结论。例如,其中一项研究报告了抑郁症患者拟杆菌门减少,这与浙江大学报告的结果相反。
这可能是因为参与这些研究的人群在基因、环境和微生物方面各不相同,更不用说他们有不同的饮食和广泛的生活经历。换句话说,研究人员还无法找到一种普遍的抑郁症微生物特征可以证明特定的肠道微生物及代谢物与抑郁之间存在直接联系。
肠道微生物在代谢食物成分时产生的一些信号分子,比如胆汁酸和激素,可能与抑郁症有关。然而,只有当我们能够完全理解这些化合物如何影响脑-肠-微生物轴的功能时,这些研究得出的结果才有意义。我们已经知道,由肠道微生物直接产生的数以千计的这样的分子,以及来自微生物与肠道相关免疫系统相互作用的许多炎症介质,都参与了这个复杂网络中的交流。
对神经递质5-羟色胺的研究采用了这种系统方法,并取得了非凡的发现。大多数5-羟色胺是在肠道菌群的帮助下产生的,但也有少量5羟色胺可以由大脑独立产生。众所周知,5-羟色胺在睡眠调节、疼痛敏感、食欲和其它重要功能中起着重要作用,它也与一些脑部疾病有关,特别是抑郁症和自闭症。在肠道中,5-羟色胺有助于调节肠道运动和分泌。
必需氨基酸色氨酸、肠道5-羟色胺以及另外两种神经活性色氨酸代谢物犬尿氨酸和吲哚,是脑-肠-微生物轴中研究最广泛的信号分子。
尽管5-羟色胺在微调大脑功能方面发挥着关键作用,但只有不到5%的5-羟色胺在大脑中产生并储存。脑干神经细胞中发现了少量的这种物质,这些细胞可以向大脑的所有区域发送上行投射,也可以向脊髓发送下行投射,因此,它对神经活动和行为有广泛的影响。它的影响在我们的情绪调节网络中占主导地位,因此有助于调节我们的情绪。这也是选择性5-羟色胺再摄取抑制剂(SSRIs)发挥作用的前提,SSRIs是一种抗抑郁药物,被认为是治疗抑郁症最有效的药物干预手段之一。SSRI类药物就是为了增加大脑不同区域的5-羟色胺的浓度。
我们身体中的其它95%的5-羟色胺是由肠道内壁上一种被称为肠嗜铬细胞(ECCs)的特殊细胞分泌的,它就是5-羟色胺的仓库。当受到微生物或肠道内容物的刺激时,肠嗜铬细胞会在肠壁分泌5-羟色胺,它可以分泌到感觉神经末梢,也可以进入循环以及进入肠腔。
但是,5-羟色胺无法通过血脑屏障。然而,肠道中释放的5-羟色胺却可以对大脑功能有重要影响,因为它的重要目标是迷走神经的感觉末梢。当受到刺激时,它们会向大脑中的情绪调节网络产生长距离的迷走神经信号,因此肠道的5-羟色胺能够以这种方式向大脑发送信号。
我们的肠道微生物可以对我们所吃的食物做出反应,从而影响肠道中5-羟色胺的合成和分泌,因此,这些微生物的活动可能对大脑和我们的许多重要功能产生重要影响,比如疼痛敏感性、睡眠和食欲等。我们所吃的食物、肠道微生物和肠道之间的交流是双向的。肠道微生物为肠嗜铬细胞中5-羟色胺的产生提供了重要的刺激,部分5-羟色胺被分泌到肠腔,在那里它可以影响肠道微生物。最近的研究表明,这种分泌到肠腔内的5-羟色胺在肠道菌群和肠道细胞之间扮演着重要的中介角色。
为了更好地理解微生物在调节5-羟色胺和其它色氨酸代谢产物中的作用,研究人员对无菌小鼠和正常小鼠进行了比较。在一项这样的研究中,科学家们发现无菌小鼠血液循环中的5-羟色胺含量仅为拥有正常菌群的小鼠5-羟色胺含量的一半。此外,正常小鼠中较高的5-羟色胺浓度伴随着5-羟色胺产生所必需的基因的丰富表达。这些发现证明,某些肠道微生物可以调节5-羟色胺的合成以及脑-肠-微生物网络中的5-羟色胺信号传递。
加州大学洛杉矶分校的Elaine Hsiao博士通过一系列精巧的实验,证明了短链脂肪酸(肠道细菌发酵膳食纤维产生的代谢物)和次级胆汁酸负责肠嗜铬细胞中近一半的5-羟色胺的合成。这是通过微生物对肠嗜铬细胞内的一种特殊酶的刺激实现的,这种酶负责将食物中的色氨酸代谢成5-羟色胺的第一步。
根据Hsiao博士的研究发现,微生物接触到的色氨酸越多,它们刺激肠嗜铬细胞产生的5-羟色胺就越多。换句话说,我们给肠道微生物提供的富含膳食纤维和色氨酸的食物越多,它们刺激肠道5-羟色胺的分泌就越多,可对全身提供广泛的好处。
这还只是故事的一部分,Hsiao博士最近的研究揭示,微生物本身也会受到它们所刺激分泌的5-羟色胺的影响。Hsiao发现,某些微生物的细胞膜上有一种分子,与血小板和脑细胞细胞膜上的分子非常相似,这种分子能使这些细胞吸收5 -羟色胺。这种5-羟色胺转运体与大脑中的神经细胞表达的分子是相同的,它也是SSRI类抗抑郁药的靶点,比如西酞普兰和百忧解。
换句话说,肠嗜铬细胞释放到肠腔的5-羟色胺可以被微生物吸收,改变它们的行为。虽然微生物吸收5 -羟色胺对我们的健康的影响仍然是未知的,但有人猜测,抗抑郁药可能不仅作用于大脑,还可能通过增加肠腔内5-羟色胺的水平,影响肠嗜铬细胞和微生物之间的交流。
肠道中5-羟色胺水平的增加可能不仅在服用SSRIs的患者报告的常见胃肠道副作用中发挥作用,也可能在抗抑郁药物治疗的一些独特的临床特征中发挥作用。例如,肠道菌群的差异以及饮食的差异,可能是一个人对这组药物的反应和副作用的差异的基础。此外,肠道微生物参与5-羟色胺生理学,那么饮食干预作为药物的补充,对抑郁症患者具有有益作用。
科学表明,肠道菌群不仅在刺激肠嗜铬细胞产生5-羟色胺方面起着关键作用,而且在色氨酸分解为神经活性分子方面的作用更为广泛。
其中一种与大脑功能和脑部疾病直接相关的色氨酸代谢物是犬尿氨酸。在胃肠道中,犬尿氨酸是由吲哚胺-2,3-双加氧酶(IDO)的作用下由色氨酸合成的。这种基于肠道的酶以及相关的犬尿氨酸产生在很大程度上受到肠道健康和某些微生物活动的影响。厚壁菌门中的一类微生物在调节肠嗜铬细胞中5-羟色胺的合成方面起着至关重要的作用,但乳酸杆菌决定了多少色氨酸被转化为犬尿氨酸。
虽然我们很多人都熟悉色氨酸和“快乐分子”5-羟色胺,但可能很少有人知道犬尿氨酸,它在慢性压力对我们的身体和大脑的影响中发挥着同样重要但是相反的作用。大量的科学研究都发现,多种脑部疾病中都存在犬尿氨酸失调,包括抑郁症和阿尔茨海默病。例如,在小鼠、大鼠、灵长类动物和人类中都已证明,慢性压力会减少乳酸杆菌的相对丰度。在大鼠中,研究表明这种减少会降低动物将色氨酸分解为5-羟色胺的能力。
慢性压力伴随着IDO酶的增加,这会导致犬尿氨酸的增加,与5-羟色胺不同,犬尿氨酸可以自由地从血液进入大脑。大脑中犬尿氨酸增加的一些最重要的影响是神经炎症和神经退行性病变,这与某些形式的抑郁症和阿尔茨海默病有关。
此外,由于犬尿氨酸会与色氨酸竞争穿过血脑屏障,肠道中产生的犬尿氨酸越多,大脑中用于制造5-羟色胺的色氨酸就越少。犬尿氨酸与5-羟色胺比值的增加与阿尔茨海默病和某些形式的抑郁症有关。
因此,减少慢性压力和改变饮食习惯,以调节肠道菌群组成和功能,可能会减少转化为犬尿氨酸的色氨酸的数量,从而将平衡转向5-羟色胺的合成方向,这可能也对于一些脑部疾病的治疗具有有益作用。
虽然膳食色氨酸转化为5-羟色胺和犬尿氨酸的代谢是由肠道细胞完成并由微生物调节的,但只有肠道微生物本身能够将色氨酸代谢为另一组代谢物,那就是吲哚类化合物,它们在人体和大脑中也具有广泛的功能。例如,有的吲哚代谢物被证明可能有助于调节影响我们食欲的大脑网络;而另一种代谢物硫酸吲哚酚可能在自闭症、阿尔茨海默病和抑郁症的发生中发挥作用。
因此,由肠道微生物调节或产生的色氨酸代谢物,在我们的脑-肠-微生物轴中发挥着关键作用,不健康的饮食和/或长期的压力都可能导致这个复杂的通信系统发生变化。
 3. 压力对抑郁症的强化作用
3. 压力对抑郁症的强化作用
在脑部疾病中,包括抑郁症、帕金森病、阿尔茨海默病和自闭症,患者以一种健康和适应性的方式与世界互动的能力受到损害,这意味着他们经历着一种长期激活的应激反应。
例如,随着认知能力的下降,人们会一次又一次地意识到他们的大脑和记忆正在衰退,从而产生焦虑;在自闭症中,人际交往和社交技能受损以及由此产生的孤独感会导致压力;在抑郁症中,遗传和表观遗传因素的相互作用使人们对压力反应过度,使他们在儿童时期更容易患上焦虑症,这反过来又使他们在以后的生活中更有可能患上抑郁症。事实上,一些证据表明,一个人的焦虑开始得越早,抑郁就越有可能随之而来。
这种“战斗或逃跑”反应的持续参与以及随之而来的恐惧反应,会给脑-肠-微生物轴自上而下的带来了额外的负担,这反过来又会影响肠道,导致肠道菌群的不利变化,例如产色氨酸代谢物犬尿氨酸和吲哚的细菌数量增加,从而增加了低度免疫激活。这些转变通过代谢物、免疫介质和迷走神经活动等信号传递回大脑,加强并延续原有的大脑功能紊乱,甚至可能导致结构性的大脑变化。这种恶性循环会一直在进行。
在脑-肠-微生物轴研究中,很少有领域能够像那些证明急性和慢性应激对肠道菌群组成的影响的研究那样,在临床前和人体研究中显示出如此一致的结果。2017年,《科学报告》上发表的一项研究对这些发现进行了有意义的扩展。研究人员发现,慢性应激小鼠的情绪行为、肠道菌群组成及其代谢物特征发生了显著变化。与之前关于慢性应激对肠道菌群影响的研究一致,他们观察到最显著的变化是乳酸杆菌的比例显著减少,循环中的犬尿氨酸水平增加。值得注意的是,给这些应激老鼠补充乳酸杆菌,可以恢复肠道内的乳酸杆菌水平到足以降低犬尿氨酸水平和改善行为异常。
事实上,乳杆菌属的细菌成员有能力产生高水平的过氧化氢,以维持其在高度竞争的肠道微生物生态系统中的生态位。结果表明,乳酸杆菌产生过氧化氢可能通过直接抑制肠道吲哚胺-2,3-双加氧酶(IDO)来防止慢性应激诱导的抑郁行为的发生。这反过来又会降低犬尿氨酸水平,我们知道犬鸟氨酸与抑郁症和其它脑部疾病有关。
一些人类研究也表明,某些特定的乳酸杆菌菌株可以减轻压力和焦虑,研究人员甚至可以通过功能性磁共振成像看到大脑中的明显变化。当然,我们还需要更大规模的人类临床研究来证明益生菌在治疗抑郁等脑部疾病中的作用。但是,现在的研究足以支持一种可能性,那就是以肠道菌群为靶点,可能是抗抑郁治疗的一个非常重要的组成部分。此外,我们所吃的东西对它们的严重程度有影响,这也让我们所有人都有机会通过饮食来改善大脑健康。
文章来源:菌情观察室
图片均来自网络
参考资料:
Ghosh, S. S., et al. (2020). "Intestinal Barrier Dysfunction, LPS Translocation, and Disease Development." J Endocr Soc 4(2): bvz039.
Jiang, H., et al. (2015). "Altered fecal microbiota composition in patients with major depressive disorder." Brain Behav Immun 48: 186-194.
Zheng, P., et al. (2016). "Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host's metabolism." Molecular Psychiatry 21(6): 786-796.
Kelly, J. R., et al. (2016). "Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat." Journal of Psychiatric Research 82: 109-118.
Yano, J. M., et al. (2015). "Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis." Cell 161(2): 264-276.
Marin, I. A., et al. (2017). "Microbiota alteration is associated with the development of stress-induced despair behavior." Scientific Reports 7: 43859.
新营养留言互动
您的电话不会被公开。 必填项已用 * 标注
相关热词搜索:
上一篇:「幽门螺杆菌」频上热搜的背后:国人“保胃战”刻不容缓
下一篇:今天下午15:00| 摆脱「智商税」标签,学会“聪明”孵化益生菌
新营养峰会/活动
新营养热门资讯
新营养周报 | 农夫山泉上新蓝靛果混合汁
数据 / 观察 · 01-06
新营养周报 | 蒙牛推出早餐奶新品、纽曼
数据 / 观察 · 12-29
一图读懂 | 2024新营养肠道微生态格局与
XINGRAPHIC · 12-29
新营养周报 | 达芬奇优形推出纤体杯新品
数据 / 观察 · 12-23